מְחַבֵּר:
Louise Ward
תאריך הבריאה:
11 פברואר 2021
תאריך עדכון:
1 יולי 2024

תוֹכֶן
גודלו של אטום הוא כה קטן עד שקשה למדוד במדויק את מספר האטום של תרכובת כימית. כדי להיות מסוגל למדוד כמות חומרים במדויק, מדענים משתמשים ביחידת שומה כדי לייצג מספר מוגדר של אטומים. שומה אחת של חומר מוגדרת כמקבילה למספר אטומי הפחמן הכלולים ב- 12 גרם איזוטופ פחמן, שהם כ- 6,022 x 10 אטומים. ערך זה נקרא מספר Avogadro, או קבוע Avogadro. זה מכונה גם מספר האטומים בשומה אחת מכל יסוד, ו- 1 מול ממסתו של חומר נקרא המסה הטוחנת של אותו חומר.
צעדים
שיטה 1 מתוך 2: חישוב המסה הטוחנת של יסוד
הגדרת מסת טוחנת. מסת טוחנת של חומר היא המסה (בגרמים) של שומה אחת של אותו חומר. כדי לחשב את המסה הטוחנת של יסוד, הכפל את המסה האטומית שלו בגורם ההמרה גרם למול (g / mol).
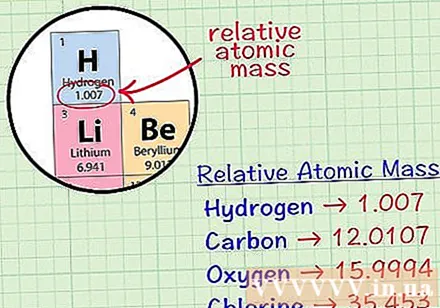
מצא את האטום המעוקב הממוצע של יסוד. אטום המסה הממוצע של יסוד הוא המסה הממוצעת, ביחידות אטומיות, במדגם הכולל את כל האיזוטופים של אותו יסוד. מידע זה ניתן לעיתים קרובות בטבלה המחזורית של אלמנטים. על ידי איתור יסוד תוכלו למצוא אטום מעוקב ממוצע שנכתב ממש מתחת לסמל הכימי של היסוד. ערך זה אינו מספר שלם, אלא מספר עם עשרוני.- לדוגמא, עם מימן, אטום המסה הממוצע הוא 1.007; האטום המעוקב הממוצע של פחמן הוא 12,0107; אטום המסה הממוצע של חמצן הוא 15,9994; לכלור מסה אטומית ממוצעת של 35,453.

הכפל את אטום המסה הממוצע בקבוע המסה הטוחנת. יחידת הגלישה הטוחנת מוגדרת כ- 0.001 קילוגרם למול, או 1 גרם למול. תוצר האטום המוני הממוצע וקבוע המסה הטוחנת ממיר את יחידת המסה האטומית לגרם לשומה, כך שהמסה הטוחנת של מימן תהיה 1.007 גרם לשומה ופחמן היא 12. , 0107 גרם לשומה, חמצן הוא 15,9995 גרם לשומה, וזה של כלור הוא 35,453 גרם לשומה.- כמה יסודות קיימים בטבע כמולקולות המורכבות משניים או יותר מאותם אטומים. כלומר, אם ברצונך לחשב את המסה הטוחנת של תרכובות המורכבות ביותר מאטום אחד, כגון גז מימן, גז חמצן או גז כלור, עליך לקבוע את המסה האטומית הממוצעת של התרכובת ולהכפיל ערך זה. עם המסה הטוחנת קבועה, "ואז" הכפל את המוצר שמצאת זה עתה ב -2.
- עם ח2: 1,007 x 2 = 2,014 גרם למול; עבור O2: 15,9994 x 2 = 31,9988 גרם למול; וקל2: 35,453 x 2 = 70,096 גרם למול.
שיטה 2 מתוך 2: חשב את המסה הטוחנת של התרכובת

קבע את הנוסחה המבנית של התרכובת. הנוסחה המבנית של חומר נותנת את המספר האטומי של כל יסוד המרכיב את אותה תרכובת. (מידע זה זמין בכל ספרי העיון). לדוגמא, הנוסחה הכימית של חומצה הידרוכלורית היא HCl; של גלוקוז הוא C6ה12או6. בעזרת נוסחה מבנית זו אנו יכולים לקבוע את מספר כל סוג אטום המהווה את התרכובת הנבדקת.- כאשר ל- HCl אטום מימן אחד ואטום כלור אחד.
- מולקולת סוכר גלוקוז C6ה12או6 בעל 6 אטומי פחמן, 12 אטומי מימן ו -6 אטומי חמצן.
קבע את אטום המסה הממוצע של כל יסוד המרכיב. השתמש בטבלה המחזורית כדי למצוא את אטום המסה הממוצע של כל יסוד הקיים בתרכובת. אטום המסה הממוצע נכתב בדרך כלל תחת הסמל הכימי של היסוד בטבלה המחזורית. בדומה לחישוב המסה הטוחנת של יסוד, הכפל את אטום המסה הממוצע ב -1 גרם למול.
- אטום המסה הממוצע של היסודות היוצרים חומצה הידרוכלורית הוא כדלקמן: מימן 1,007 גרם למול וכלור 35,453 גרם למול.
- אטום המסה הממוצע של היסודות המרכיבים את מולקולת הגלוקוז הוא: פחמן, 12,017 גרם למול; מימן, 1,007 גרם למול; וחמצן, 15.9995 גרם למול.
חשב את המסה הטוחנת של כל רכיב רכיב. הכפלת אטום המסה של יסוד במספר האטומים שהוא תורם בתרכובת נותנת את המסה הממוצעת של היסוד בתרכובת.
- במקרה של חומצה הידרוכלורית, חומצה הידרוכלורית, המסה הטוחנת של היסוד מימן היא 1,007 גרם למול, והכלור הוא 35,453 גרם למול.
- במקרה של גלוקוז, C6ה12או6, המסה הטוחנת של כל יסוד היא כדלקמן: פחמן, 12,0107 x 6 = 72,0642 גרם למול; מימן, 1,007 x 12 = 12,084 גרם למול; חמצן, 15,9995 x 6 = 95,9964 גרם למול.
המסה הטוחנת הכוללת של היסודות המרכיבים. המסה הטוחנת הכוללת של יסודות הקומפוסטציה היא המסה הטוחנת של התרכובת.בשלב הקודם חישבנו את המסה הטוחנת של כל יסוד הקיים בתרכובת, בשלב זה עלינו רק להוסיף את כל הערכים הללו יחד.
- המסה הטוחנת של חומצה הידרוכלורית היא 1,007 + 35,453 = 36,460 גרם למול. 36.46 גרם הוא המסה של 1 מול של חומצה הידרוכלורית.
- המסה הטוחנת של גלוקוז היא 72,0642 + 12,084 + 95,9964 = 180,1446 גרם למול. כך שלכל מולקולת גלוקוזה יש מסה של 180.14 גרם.
עֵצָה
- למרות שברוב המקרים האטום המוני הממוצע מתועד לחלק 1 הקרוב ביותר 1000 (4 מקומות עשרוניים), במעבדות, המסה הטוחנת לרוב מופחתת ל -2 מקומות עשרוניים, לפעמים אפילו פחות, למולקולות גדולות. לכן, במקרה המעבדה, המסה הטוחנת של חומצה הידרוכלורית יכולה להיכתב כ- 36.46 גרם למול, לגלוקוז 180.14 גרם למול.
מה אתה צריך
- ספר עיון כימי או טבלה מחזורית של יסודות
- מַחשֵׁב