מְחַבֵּר:
Lewis Jackson
תאריך הבריאה:
6 מאי 2021
תאריך עדכון:
1 יולי 2024
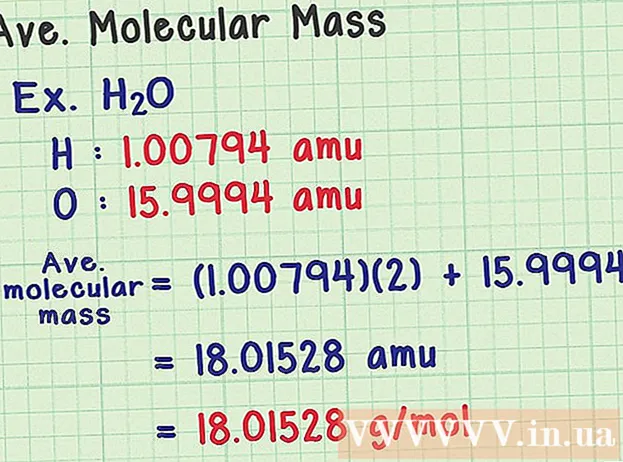
תוֹכֶן
אטום המסה הממוצע אינו מדד ישיר למסתו של האטום. במקום זאת, זהו המסה הממוצעת לאטום מדגימה אופיינית של היסוד. אם אתה יכול למדוד את המסה של מיליארדי אטומים בודדים, אתה יכול לגלות זאת על ידי חישוב הממוצע שלהם. יש לנו שיטה מעשית יותר, המבוססת על מידע על האיזוטופים השונים של היסוד הכימי.
צעדים
חלק 1 מתוך 2: חשב את אטום המסה הממוצע
להבין איזוטופים ואטומי המסה. בטבע, רוב האלמנטים קיימים בצורות או איזוטופים רבים. ההבדל היחיד בין שני איזוטופים של אותו יסוד הוא מספר הנויטרונים באטום, שמספר הנייטרונים משפיע על אטום המסה. חישוב האטום המוני הממוצע לוקח בחשבון את ההשפעה של הבדל זה, ואומר לך את המסה הממוצעת של כל אטום במדגם של אותם אטומים.
- לדוגמא, לאלמנט כסף (Ag) שני איזוטופים טבעיים: Ag-107 ו- Ag-109 (או Ag ו- Ag). האיזוטופ נקרא על שם "מספר המסה", או סכום מספר הפרוטונים ומספר הנייטרונים באטום. כלומר ל- Ag-109 יש שני נויטרונים יותר מאשר ל- Ag-107, ולכן האטום שלה קצת כבד יותר.

מצא את המסה של כל איזוטופ. אתה זקוק לשני פיסות מידע לכל איזוטופ, אתה יכול לחפש אותם בספרי עיון או לחפש באינטרנט, למשל webelements.com. הראשון הוא אטום המסה או המסה האטומית של כל איזוטופ. לאיזוטופים עם יותר נויטרונים יש יותר מסת.- לדוגמא, לאיזוטופ הכסף Ag-107 יש אטום המוני 106,90509 אמו (היחידה של אטום מעוקב). איזוטופ Ag-109 מעט כבד יותר עם מסה של 108,90470.
- צמד העשרונים בסוף יכול להיות שונה במקצת במסמכים. אל תכתוב מספרים בסוגריים אחרי המיסה.

כתוב את שיעור ההישרדות הטבעי של כל איזוטופ. יחס זה מציין את שכיחות האיזוטופ, כאחוז מסך האטומים של היסוד. תוכל למצוא מידע זה באותו מסמך ועליו אטום מעוקב. ההישרדות הטבעית של כל האיזוטופים צריכה להיות 100% (אם כי היא עשויה להיות שונה מעט עקב טעות בעיגול).- לאיזוטופ Ag-107 היחס הוא 51.86%. האיזוטופ Ag-109 נפוץ פחות בשיעור של 48.14%. כלומר מדגם כסף רגיל כולל 51.86% Ag-107 ו- 48.14% Ag-109.
- מתעלמים מכל איזוטופים שאין להם שיעור הישרדות זה. איזוטופים אלה אינם קיימים באופן טבעי על פני האדמה.

המירו את אחוז האיזוטופ למספר עשרוני. חלק את היחס הזה ב 100 יניב את אותו הערך כמו עשרוני.- במדגם הכסף לעיל, יחס האיזוטופים הוא 51.86 / 100 = 0,5186 ו 48,14 / 100 = 0,4814.
מצא את האטום המעוקב הממוצע. לאטום המסה הממוצע של יסוד יש נ איזוטופים שווים (בלוק אטומיאיזוטופ 1 יחס *איזוטופ 1) + (מסה אטומיתאיזוטופ 2 יחס *איזוטופ 2) + ... + (מסת אטומיתאיזוטופים נ יחס *איזוטופים נ. זו דוגמה ל"מסה ממוצעת ", כלומר ככל שכשיעור ההישרדות של האיזוטופ גדול יותר, כך השפעתו על התוצאה גדולה יותר. כיצד ליישם נוסחה זו לכסף היא כדלקמן:
- אטום מסה בינוניאג = (אטום המוניAg-107 יחס *Ag-107) + (מסה אטומיתAg-109 יחס *Ag-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107.8677 אמו. - מצא את האלמנט בטבלה המחזורית כדי לבדוק את התוצאות. האטום המעוקב הממוצע נכתב תמיד מתחת לסמל הכימי של היסוד.
- אטום מסה בינוניאג = (אטום המוניAg-107 יחס *Ag-107) + (מסה אטומיתAg-109 יחס *Ag-109)
חלק 2 מתוך 2: שימוש בתוצאות
המר המסה למספר אטומי. אטום מעוקב ממוצע מראה את הקשר בין המסה למספר האטומי במדגם טיפוסי של אותו יסוד. זה מאוד שימושי במעבדות כימיות מכיוון שכמעט בלתי אפשרי לספור אטומים במדויק, אך קל לקבוע מסות. לדוגמה, תוכל לשקול דגימת כסף ולדעת שיהיה אטום כסף אחד לכל 107,8677 אמו.
המר להמסה טוחנת. יחידת המסה האטומית קטנה מאוד, ולכן כימאים משתמשים לעיתים קרובות ביחידת הגרם לצורך מסה. למרבה המזל יש לנו הגדרות של מושגים אלה ולכן השינוי צריך להיות קל. פשוט הכפל את אטום המסה הממוצע ב- 1 גרם למול (קבוע מסה טוחנת) כדי להשיג תוצאה ב- g / mol. לדוגמה, 107,8677 גרם כסף מכילים שומה אחת של אטומי כסף.
מצא את המסה המולקולרית הממוצעת. מכיוון שמולקולה היא אוסף של אטומים, אתה יכול להוסיף את המסה של כל האטומים כדי למצוא את המסה המולקולרית. אם היית משתמש באטום מסה ממוצע (במקום במסה של איזוטופ מסוים), התוצאה תהיה המסה המולקולרית הממוצעת של דגימה בטבע. הנה דוגמא:
- למולקולת מים הנוסחה הכימית H2O מכיל שני אטומי מימן (H) ואטום חמצן אחד (O).
- למימן אטום מסה ממוצע של 1,00794 אמו. לחמצן מסה אטומית ממוצעת של 15,9994 אמו.
- אז המסה המולקולרית הממוצעת של H2O שווה ל- (1,00794) (2) + 15,9994 = 18,01528 אמו, שווה ערך ל- 18,01528 גרם למול.
עֵצָה
- המושג מסה אטומית יחסית משמש לעתים שם נרדף לאטום מסה ממוצע. יש הבדל קל מכיוון שהמסה האטומית יחסית אינה יחידה; זהו מדידה של המסה ביחס לאטום פחמן 12. כל עוד אתה משתמש ביחידת המסה האטומית בחישוב האטום הקובי הממוצע, שני הערכים האלה זהים.
- המספר בסוגריים אחרי האטום המעוקב אומר לנו את השגיאה. לדוגמא, אטום מסה 1.0173 (4) פירושו שלאטום הרגיל של היסוד יש טווח מסה של כ 1.0173 ± 0.0004. אינך צריך להשיג את המספר הזה אם לא מבקשים ממנו.
- בטבלה המחזורית האטום הקובי הממוצע של היסוד הבא גדול יותר מזה שלפניו, למעט יוצאים מן הכלל. הנה דרך מהירה לבדוק את התוצאות שלך.
- יחידת מסה אטומית אחת היא 1/12 ממסה של אטום פחמן -12.
- שיעורי ההישרדות של איזוטופים מחושבים על פי דפוסים טבעיים האופייניים לכדור הארץ. חומרים שאינם טבעיים כמו מטאוריטים או כאלה המיוצרים במעבדה יכולים להיות בעלי יחסי איזוטופ שונים, כך שגם אטום המסה הממוצע שונה.
אַזהָרָה
- אטומי המסה נכתבים תמיד ביחידות מסה אטומיות (amu או u), המכונות לפעמים דלטונים (Da). לעולם אל תכתוב יחידה אחרת של מסה (כגון קילוגרם) אחרי מספר זה מבלי לשנות אותה.
מה אתה צריך
- עִפָּרוֹן
- עיתון
- מחשב נייד
- נתונים על שיעור הישרדות איזוטופ בטבע.
- נתוני יחידות אטומיות המוניות לאיזוטופים.