מְחַבֵּר:
Lewis Jackson
תאריך הבריאה:
8 מאי 2021
תאריך עדכון:
25 יוני 2024

תוֹכֶן
המשוואה היונית נטו היא חלק חשוב בכימיה מכיוון שהיא מייצגת רק את החלקיקים המשתנים בתגובה כימית. הם משמשים לרוב בתגובות להפחתת חמצון, תגובות מטבוליות ותגובות ניטרול של חומצות - בסיסים. ישנם שלושה שלבים בסיסיים לכתיבת משוואה יונית נטו: איזון המשוואה המולקולרית, המרתה למשוואה היונית המלאה (כיצד כל חומר קיים בתמיסה), ולבסוף כתוב את המשוואה היונית נטו.
צעדים
חלק 1 מתוך 2: הבנת מרכיבי המשוואה היונית
דע את ההבדל בין מולקולות ל תרכובות יוניות. השלב הראשון בכתיבת משוואה יונית נטו הוא קביעת התרכובות היוניות בתגובה. תרכובות יוניות הן כאלו המנתקות יונים בתמיסה מימית ובעלות מטען חשמלי. תרכובות מולקולריות הן תרכובות שלעולם אין להן מטען חשמלי. הם נוצרים בין שתי מתכות ולעתים מכונים תרכובות קוולנטיות.
- תרכובות יוניות יכולות להיווצר בין מתכות ללא מתכות, מתכות ויונים פולי-אטומיים, או יונים פולי-אטומיים מרובים.
- אם אינך בטוח מה התרכובת, תוכל לחפש את האלמנטים במתחם זה בטבלה המחזורית.

זיהוי המסיסות של תרכובת. לא כל התרכובות היוניות מסיסות בתמיסה מימית, ולכן אינן יכולות להתנתק ליונים. עליך לזהות את המסיסות של כל תרכובת לפני שתמשיך בשאר המשוואה. להלן סיכום כללי המסיסות. מצא גיליון אלקטרוני של מסיסות למידע מפורט יותר וחריגים מכללים אלה.- פעל לפי כללים אלה לפי הסדר המתואר להלן:
- כל מלחי Na, K ו- NH4 כולם נמסים.
- כל המלחים ללא3, ג2ה3או2, ClO3ו- ClO4 כולם נמסים.
- כל מלחי Ag, Pb ו- Hg2 כולם נמסים.
- כל המלחים של Cl, Br ו- I מסיסים.
- כל מלחי CO3, O, S, OH, PO4, CrO4, Cr2או7, ו- SO3 מומסים (למעט מקרים ספורים).
- כל מלחי SO4 מומסים (למעט מקרים ספורים).
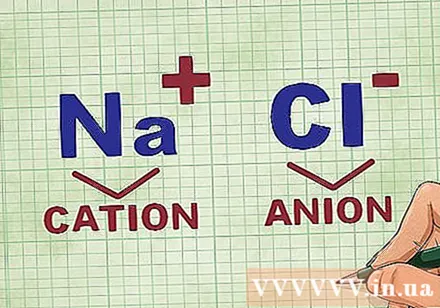
קביעת קטיונים ואניונים במתחם. קטיונים הם היונים החיוביים בתרכובת והם בדרך כלל המתכת. האניון הוא היון השלילי בתרכובת ואינו מתכתי. חלק מהמתכות שאינן מתכות יכולות ליצור קטיונים, אך מתכות תמיד יוצרות קטיונים.- לדוגמא, ב- NaCl, Na הוא הקטיון בעל הטעינה החיובית מכיוון שהוא מתכת, ו- Cl הוא האניון הטעון שלילית מכיוון שהוא אינו מתכתי.

זיהוי יונים פולי-אטומיים בתגובה. יונים פולי-אטומיים הם מולקולות טעונות המאוגדות היטב יחד ואינן מתנתקות במהלך תגובות כימיות. חשוב לזהות יונים פולי-אטומיים מכיוון שיש להם מטען ספציפי ואינם מתנתקים. ליונים פולי-אטומיים יכול להיות מטען חיובי או שלילי.- אם אתה לומד כימיה כללית, לעתים קרובות נדרש לזכור כמה יונים פולי-אטומיים נפוצים.
- כמה יונים פולי-אטומיים נפוצים הם CO3, לא3, לא2, לכן4, לכן3, ClO4 ו- ClO3.
- אתה יכול גם למצוא יונים רבים אחרים בספרי כימיה או באינטרנט.
חלק 2 מתוך 2: כתיבת משוואה יונית נטו
איזון משוואות מולקולריות. לפני כתיבת משוואה יונית נטו, עליכם לוודא שהמשוואה המולקולרית שלכם מאוזנת. כדי לאזן את המשוואה, מוסיפים מקדמים מול המתחם כך שהמספר האטומי של כל יסוד יהיה שווה משני צידי המשוואה.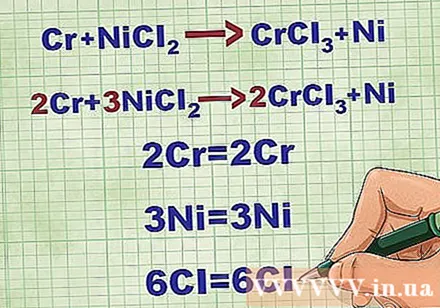
- כתוב את מספר האטומים המרכיבים כל תרכובת משני צידי המשוואה.
- הוסף מקדם מול אלמנטים שאינם חמצן ומימן כדי לאזן כל צד.
- איזון אטומי מימן.
- איזון אטומי של חמצן.
- ספר מחדש את מספר האטומים בכל צד של המשוואה כדי לוודא שהם מאוזנים.
- לדוגמא, Cr + NiCl2 -> CrCl3 + ני מאוזן ל- 2Cr + 3NiCl2 -> 2CrCl3 + 3 ני.
זהה את מצבי התרכובות במשוואה. פעמים רבות בבעיה יש מילות מפתח שיאפשרו לך לדעת את המצב של כל מתחם. ישנם מספר כללים המסייעים בקביעת מצבו של אלמנט או תרכובת.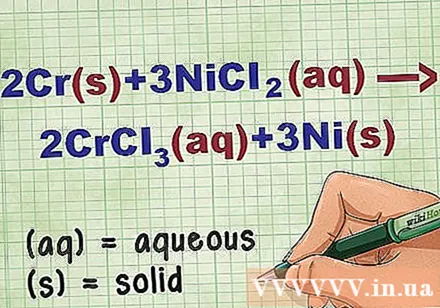
- אם אין מצב לאלמנט, השתמש במצב המצוי בטבלה המחזורית.
- אם התרכובת נקראת פיתרון, אתה יכול לכתוב אותה כמימית או (dd).
- אם יש מים במשוואה, עליך לקבוע אם התרכובת היונית מסיסה במים באמצעות הגיליון האלקטרוני למסיסות. אם המסיסות גבוהה, התרכובת תהיה מימית (dd), אם המסיסות נמוכה, התרכובת תהיה מוצקה (ר).
- ללא מים, התרכובת היונית מוצקה (ר).
- אם הבעיה חומצית או בסיסית, התרכובת מימית (dd).
- לדוגמה, 2Cr + 3NiCl2 -> 2CrCl3 + 3 ני. צורות היסוד של Cr ו- Ni נמצאות במצב מוצק. NiCl2 ו- CrCl3 תרכובות יוניות מסיסות, ולכן הן מימיות. כתוב את המשוואה מחדש כ: 2Cr(ר) + 3 ניקל2(dd) -> 2CrCl3(dd) + 3 ני(ר).
קבע אילו תרכובות יתנתקו (יתנתקו לקטיונים ואניונים) בתמיסה. כאשר חומר או תרכובת מתנתקים, הם מתנתקים ליון טעון חיובי (קטיון) וליון טעון שלילי (אניון). אלה המרכיבים שיוקוונו בסוף המשוואה היונית נטו.
- מוצקים, נוזלים, גזים, תרכובות מולקולריות, תרכובות יוניות מסיסות נמוכות, יונים פולי-אטומיים וחומצות חלשות לא יתנתקו.
- לתרכובות יוניות יש מסיסות גבוהה (השתמש בטבלת המסיסות) וחומצות חזקות ייננו 100% (HCl(dd), HBr(dd), היי(dd), ח2לכן4(dd), HClO4(dd)ו- HNO3(dd)).
- שים לב, למרות שיונים פולי-אטומיים אינם מתנתקים יותר, אם הם מורכבים מאותה תרכובת, הם מתנתקים מהמתחם.
חשב את המטען של כל יון המנותק מהמתחם. זכרו שמתכות יווצרו יונים חיוביים ושאינם מתכות ייצרו יונים שליליים. השתמש בטבלה המחזורית כדי לקבוע את מטען האלמנט. עליך גם לאזן את המטען של כל יון במתחם.
- בדוגמה זו, NiCl2 התנתק ל- Ni ו- Cl בעוד CrCl3 מתפצלים ל- Cr ו- Cl.
- ל- Ni יש מטען של 2+ כי ל- Cl יש מטען של אחד שלילי אך יש לו 2 אטומים. לכן, עלינו לאזן בין שני יוני Cl השליליים. ל- Cr יש מטען של 3+, אז עלינו לאזן בין 3 יוני ה- Cl השליליים.
- זכור כי ליונים פולי-אטומיים יש מטען ספציפי.
כתוב את המשוואה היונית השלמה. כל מה שמנתק או מיינן (חומצות חזקות) נפרד לשני יונים נפרדים. מצב החומר נותר (dd), אך וודא שהמשוואה נשארת מאוזנת.
- מוצקים, נוזלים, גזים, חומצות חלשות ותרכובות יוניות מסיסות נמוכות אינם משנים את המצב ואינם נפרדים ליונים. אנו שומרים עליהם שלמים.
- חומרים מולקולריים יתפזרו בתמיסה כך שמצבם ישתנה ל- (dd). שלושה יוצאים מן הכלל לא הפכו (dd) הוא: CH4(k), ג3ה8(k), ו- C8ה18(l).
- בהמשך לדוגמא לעיל, המשוואה היונית המלאה נראית כך: 2Cr(ר) + 3 ני(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3 ני(ר). כאשר Cl אינו נמצא בתרכובת, הוא אינו דו קוטבי, ולכן אנו מכפילים את הגורם במספר האטומים בתרכובת כדי לקבל 6 יוני Cl משני צידי המשוואה.
הסר את יוני שיווי המשקל על ידי ביטול אותם יונים בכל צד של המשוואה. ניתן לבטל רק אם הם זהים לחלוטין משני הצדדים (מטען, מספר אטומי וכו '). כתוב את המשוואה ללא החומרים ההורסים.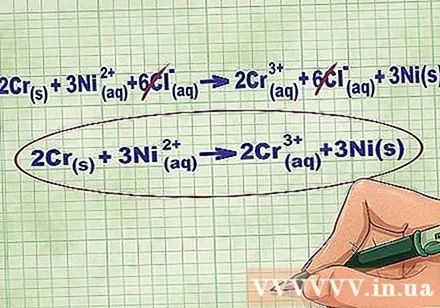
- לאחר השלמת הדוגמא, יש לנו 6 יוני שיווי משקל Cl ניתנים לביטול בכל צד. המשוואה היונית נטו היא 2Cr(ר) + 3 ני(dd) -> 2Cr(dd) + 3 ני(ר).
- אם אתה צודק אז המטען הכולל בצד המגיב צריך להיות שווה לטעינה הכוללת בצד המוצר במשוואה היונית נטו.
עֵצָה
- כתוב את מצבי כל החומרים במשוואה, אם לא אתה רָצוֹן לאבד נקודות.



