מְחַבֵּר:
Charles Brown
תאריך הבריאה:
2 פברואר 2021
תאריך עדכון:
28 יוני 2024

תוֹכֶן
- לדרוך
- שיטה 1 מתוך 3: קשרים יוניים בסיסיים
- שיטה 2 מתוך 3: מתכות מעבר
- שיטה 3 מתוך 3: קשרים עם יונים פולי-אטומיים
- טיפים
קשרי יונים מורכבים מקטיונים (יונים חיוביים) ואניונים (יונים שליליים). קשרי יונים מורכבים בדרך כלל ממתכת ואחת או יותר ממתכות. כדי לתת שם לקשר יונים, אתה רק צריך למצוא את שם הקטיון והאניון הקיימים בתרכובת. תחילה עליך לרשום את שם המתכת, ואחריו את שם המתכת עם הסוף החדש המתאים לה. אם ברצונך לדעת כיצד למנות קשרי יונים במגוון מצבים, פשוט בצע את השלבים הבאים.
לדרוך
שיטה 1 מתוך 3: קשרים יוניים בסיסיים
 רשמו את נוסחת הקשר ליונים. בוא נגיד את הקשר היוני עליו אתה עובד NaCl הוא.
רשמו את נוסחת הקשר ליונים. בוא נגיד את הקשר היוני עליו אתה עובד NaCl הוא.  כתוב את שם המתכת, או הקטיון. זהו היון הטעון החיובי בקשר והוא תמיד נכתב תחילה בנוסחת קשר יונים. לאחר הוא נתרן. אז כתוב נתרן עַל.
כתוב את שם המתכת, או הקטיון. זהו היון הטעון החיובי בקשר והוא תמיד נכתב תחילה בנוסחת קשר יונים. לאחר הוא נתרן. אז כתוב נתרן עַל.  רשמו את שם הלא-מתכת, או האניון, עם הסוף "-אידי".קל הוא כלור (כלור). כדי להוסיף את הסוף "אידי", פשוט החלף את ההברה האחרונה "-אין" ב"-ide ". הופך לכלור כלוריד.
רשמו את שם הלא-מתכת, או האניון, עם הסוף "-אידי".קל הוא כלור (כלור). כדי להוסיף את הסוף "אידי", פשוט החלף את ההברה האחרונה "-אין" ב"-ide ". הופך לכלור כלוריד.  שלב את השמות. ניתן לכתוב NaCl כ- נתרן כלורי.
שלב את השמות. ניתן לכתוב NaCl כ- נתרן כלורי.  תרגלו שמות של קשרים יונים פשוטים. לאחר שהצלחת את הנוסחה הזו, נסה למנות כמה קשרים יונים פשוטים יותר. אפילו שינון של כמה יכול לעזור לך להבין טוב יותר כיצד למנות קשרי יונים. הנה עוד כמה:
תרגלו שמות של קשרים יונים פשוטים. לאחר שהצלחת את הנוסחה הזו, נסה למנות כמה קשרים יונים פשוטים יותר. אפילו שינון של כמה יכול לעזור לך להבין טוב יותר כיצד למנות קשרי יונים. הנה עוד כמה: - לי2S = ליתיום גופרתי

- אג2S = גופרתי כסף

- MgCl2 = מגנזיום כלוריד

- לי2S = ליתיום גופרתי
שיטה 2 מתוך 3: מתכות מעבר
 רשמו את נוסחת הקשר ליונים. ניתן למצוא מתכות מעבר במרכז הטבלה המחזורית. הם קיבלו את שמם מכיוון שמספר החמצון שלהם, או המטענים שלהם, משתנים כל הזמן. נניח שאתה עובד עם הקשר הזה: Fe2או3.
רשמו את נוסחת הקשר ליונים. ניתן למצוא מתכות מעבר במרכז הטבלה המחזורית. הם קיבלו את שמם מכיוון שמספר החמצון שלהם, או המטענים שלהם, משתנים כל הזמן. נניח שאתה עובד עם הקשר הזה: Fe2או3.  רשום את מטען המתכת. אתה יודע שלמתכת תהיה מטען חיובי כדי שתוכל לקבל את 3 של או3 לחצות ולכתוב את זה Fe יש תשלום של +3. (אתה יכול, בשביל הכיף, לעשות את ההפך ולרשום את זה או יש חיוב של -2.) לפעמים החיוב יצוין.
רשום את מטען המתכת. אתה יודע שלמתכת תהיה מטען חיובי כדי שתוכל לקבל את 3 של או3 לחצות ולכתוב את זה Fe יש תשלום של +3. (אתה יכול, בשביל הכיף, לעשות את ההפך ולרשום את זה או יש חיוב של -2.) לפעמים החיוב יצוין.  רשמו את שם המתכת. מכיוון שאתה יודע את זה Fe ברזל ושיש לו תשלום של +3, אתה יכול לעשות את זה ברזל (III) להזכיר. זכור להשתמש רק בספרות רומיות בעת כתיבת השם ולא בעת כתיבת הנוסחה.
רשמו את שם המתכת. מכיוון שאתה יודע את זה Fe ברזל ושיש לו תשלום של +3, אתה יכול לעשות את זה ברזל (III) להזכיר. זכור להשתמש רק בספרות רומיות בעת כתיבת השם ולא בעת כתיבת הנוסחה.  רשמו את שם הלא מתכת. מכיוון שאתה יודע את זה או מייצג חמצן, אתה יכול להוסיף את הסוף "-אידי" ולקרוא לזה "תחמוצת".
רשמו את שם הלא מתכת. מכיוון שאתה יודע את זה או מייצג חמצן, אתה יכול להוסיף את הסוף "-אידי" ולקרוא לזה "תחמוצת".  מיזג את השם הפרטי והשני. עכשיו יש לך את זה. Fe2או3 = תחמוצת ברזל (III).
מיזג את השם הפרטי והשני. עכשיו יש לך את זה. Fe2או3 = תחמוצת ברזל (III).  השתמש בשיטת השם הישנה יותר. בשיטת השמות הישנה יותר, שבה משתמשים גם, אתה משתמש בשמות "ferro" ו" ferric "עבור המתכות, במקום הספרות הרומיות. אם ליון המתכת יש מצב חמצון נמוך יותר (מטען מספרי נמוך יותר, תוך התעלמות מה- "+" או "-"), השתמש ב"ברזל ". אם יש לו תשלום גבוה יותר אתה משתמש ב"פרי ". ל- Fe יש את המצב התחתון (ל- Fe יש את המצב הגבוה יותר), כך שהוא הופך להיות בַּרזִלִי. ניתן לכתוב את השם של FeO כמו פרוקסיד.
השתמש בשיטת השם הישנה יותר. בשיטת השמות הישנה יותר, שבה משתמשים גם, אתה משתמש בשמות "ferro" ו" ferric "עבור המתכות, במקום הספרות הרומיות. אם ליון המתכת יש מצב חמצון נמוך יותר (מטען מספרי נמוך יותר, תוך התעלמות מה- "+" או "-"), השתמש ב"ברזל ". אם יש לו תשלום גבוה יותר אתה משתמש ב"פרי ". ל- Fe יש את המצב התחתון (ל- Fe יש את המצב הגבוה יותר), כך שהוא הופך להיות בַּרזִלִי. ניתן לכתוב את השם של FeO כמו פרוקסיד. 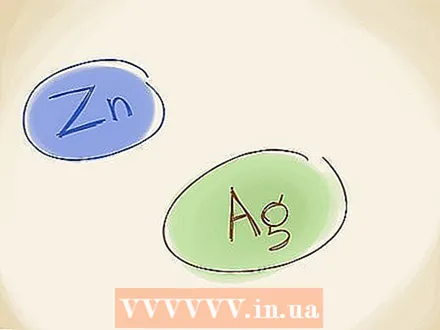 זכרו את החריגים. ישנן שתי מתכות מעבר שאין להן מטען קבוע. אלה אבץ (Zn) וכסף (Ag). פירוש הדבר כי אינך צריך להשתמש במספרים הרומיים או בשיטת השמות הישנה יותר כאשר אתה מתאר אלמנטים אלה.
זכרו את החריגים. ישנן שתי מתכות מעבר שאין להן מטען קבוע. אלה אבץ (Zn) וכסף (Ag). פירוש הדבר כי אינך צריך להשתמש במספרים הרומיים או בשיטת השמות הישנה יותר כאשר אתה מתאר אלמנטים אלה.
שיטה 3 מתוך 3: קשרים עם יונים פולי-אטומיים
 כתוב את נוסחת היונים הפוליאטומית. קשר זה יורכב ביותר משני יונים. נניח שאתה עובד על הקשר הבא: FeNH4(כך4)2.
כתוב את נוסחת היונים הפוליאטומית. קשר זה יורכב ביותר משני יונים. נניח שאתה עובד על הקשר הבא: FeNH4(כך4)2.  מצא את המטען של המתכת. תצטרך לעשות קצת מתמטיקה כדי למצוא אותה. קודם כל, אתה יודע שזה סולפט, או SO4 יון, יש מטען של -2 ושיש שניים מהם, בגלל 2 שמתחת לסוגריים. אז, 2x -2 = -4. אז אתה יודע את זה NH4, או יון האמוניה, יש מטען של +1. הוסיפו -4 ו -1 ותקבלו -3. משמעות הדבר היא כי יון הברזל, Fe, חייב להיות בעל מטען של +3 כדי להשוות אותו ולהפוך את הקשר לניטראלי.
מצא את המטען של המתכת. תצטרך לעשות קצת מתמטיקה כדי למצוא אותה. קודם כל, אתה יודע שזה סולפט, או SO4 יון, יש מטען של -2 ושיש שניים מהם, בגלל 2 שמתחת לסוגריים. אז, 2x -2 = -4. אז אתה יודע את זה NH4, או יון האמוניה, יש מטען של +1. הוסיפו -4 ו -1 ותקבלו -3. משמעות הדבר היא כי יון הברזל, Fe, חייב להיות בעל מטען של +3 כדי להשוות אותו ולהפוך את הקשר לניטראלי.  רשמו את שם המתכת. במקרה זה, אתה יכול לעשות את שניהם ברזל (III) כפי ש בַּרזִלִי לִרְשׁוֹם.
רשמו את שם המתכת. במקרה זה, אתה יכול לעשות את שניהם ברזל (III) כפי ש בַּרזִלִי לִרְשׁוֹם.  רשמו את שם היונים הלא מתכתיים. במקרה זה אתה משתמש אַמוֹנִיוּם ו סולפט, או אמוניום סולפט.
רשמו את שם היונים הלא מתכתיים. במקרה זה אתה משתמש אַמוֹנִיוּם ו סולפט, או אמוניום סולפט.  שלב את שם המתכת עם שמות הלא מתכות. אתה יכול למנות את הקשר FeNH4(כך4)2 לתת על ידי או ברזל (III) אמוניום סולפט אוֹ ברזל אמוניום גופרתי לכתוב.
שלב את שם המתכת עם שמות הלא מתכות. אתה יכול למנות את הקשר FeNH4(כך4)2 לתת על ידי או ברזל (III) אמוניום סולפט אוֹ ברזל אמוניום גופרתי לכתוב.
טיפים
- אם אתה הולך בכיוון ההפוך ויש לך מספרים רומיים, עליך לבצע "רנטגן" של המולקולה. הספרה הרומית היא המטען של הקטיון.