מְחַבֵּר:
Judy Howell
תאריך הבריאה:
2 יולי 2021
תאריך עדכון:
21 יוני 2024

תוֹכֶן
המספר האטומי של יסוד הוא מספר הפרוטונים בגרעין האטום היחיד של אותו יסוד. המספר האטומי של יסוד או איזוטופ אינו משתנה, כך שתוכל להשתמש במספר האטומי כדי לחשב מאפיינים אחרים של יסוד או איזוטופ, כגון מספר הנויטרונים.
לדרוך
חלק 1 מתוך 2: מציאת המספר האטומי
 מצא עותק של הטבלה המחזורית. אתה יכול למצוא אחד כאן אם אין לך אחד ביד. לכל יסוד מספר אטומי שונה, כך שאין שיטות מהירות וקלות. יהיה עליך למצוא עותק של הטבלה המחזורית או לשנן בעל פה.
מצא עותק של הטבלה המחזורית. אתה יכול למצוא אחד כאן אם אין לך אחד ביד. לכל יסוד מספר אטומי שונה, כך שאין שיטות מהירות וקלות. יהיה עליך למצוא עותק של הטבלה המחזורית או לשנן בעל פה. - ברוב ספרי הלימוד בכימיה יש טבלה מחזורית המודפסת בחלק הפנימי של הכריכה.
 מצא את האלמנט שאתה לומד. רוב הטבלאות המחזוריות מכילות את השמות המלאים של היסודות השונים, כמו גם את הסמלים הכימיים שלהם (כגון Hg לכספית). אם אתה מתקשה למצוא את היסוד, חפש באינטרנט "סמל כימי" ואחריו שם היסוד.
מצא את האלמנט שאתה לומד. רוב הטבלאות המחזוריות מכילות את השמות המלאים של היסודות השונים, כמו גם את הסמלים הכימיים שלהם (כגון Hg לכספית). אם אתה מתקשה למצוא את היסוד, חפש באינטרנט "סמל כימי" ואחריו שם היסוד.  מצא את המספר האטומי. המספר האטומי נמצא בדרך כלל בפינה השמאלית העליונה או הימנית של התיבה המכילה את היסוד, אך הוא יכול להיות ממוקם גם במקום אחר בתיבה. המספר האטומי הוא תמיד מספר שלם.
מצא את המספר האטומי. המספר האטומי נמצא בדרך כלל בפינה השמאלית העליונה או הימנית של התיבה המכילה את היסוד, אך הוא יכול להיות ממוקם גם במקום אחר בתיבה. המספר האטומי הוא תמיד מספר שלם. - אם זהו מספר עשרוני, כנראה שאתה מסתכל על המסה האטומית.
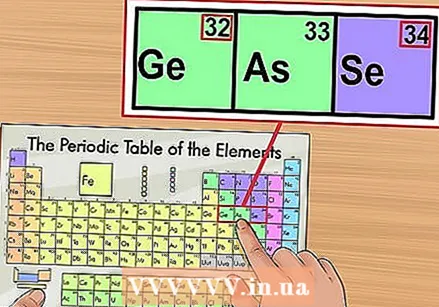 אמת כנגד גורמים שכנים. הטבלה המחזורית מסודרת לפי מספר אטומי. אם המספר האטומי של היסוד שלך הוא "33", אז האלמנט בצד שמאל צריך להיות "32" והיסוד בצד ימין צריך להיות "34". אם סדר זה נכון, ממש מצאת את המספר האטומי.
אמת כנגד גורמים שכנים. הטבלה המחזורית מסודרת לפי מספר אטומי. אם המספר האטומי של היסוד שלך הוא "33", אז האלמנט בצד שמאל צריך להיות "32" והיסוד בצד ימין צריך להיות "34". אם סדר זה נכון, ממש מצאת את המספר האטומי. - יתכן שיש חלל ריק אחרי יסודות 56 (בריום) ו- 88 (רדיום). אין למעשה מרחב; היסודות עם המספרים האטומיים השייכים לשם נמצאים בשתי שורות מתחת לשאר המערכת. הסיבה היחידה שהם כל כך מופרדים היא להפוך את הטבלה המחזורית לרחבה פחות.
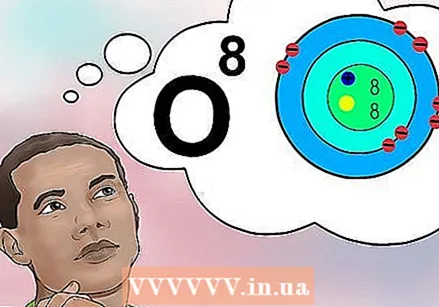 להבין מהו המספר האטומי. יש הגדרה פשוטה למספר האטומי של יסוד: מספר הפרוטונים באטום אחד של אותו יסוד. זו ההגדרה הבסיסית של אלמנט. מספר הפרוטונים קובע את המטען החשמלי הכולל של הגרעין, הקובע כמה אלקטרונים לאטום יכול להיות. מכיוון שאלקטרונים אחראים כמעט לכל התגובות הכימיות, המספר האטומי קובע בעקיפין כמעט את כל התכונות הפיזיקליות והכימיות של יסוד.
להבין מהו המספר האטומי. יש הגדרה פשוטה למספר האטומי של יסוד: מספר הפרוטונים באטום אחד של אותו יסוד. זו ההגדרה הבסיסית של אלמנט. מספר הפרוטונים קובע את המטען החשמלי הכולל של הגרעין, הקובע כמה אלקטרונים לאטום יכול להיות. מכיוון שאלקטרונים אחראים כמעט לכל התגובות הכימיות, המספר האטומי קובע בעקיפין כמעט את כל התכונות הפיזיקליות והכימיות של יסוד. - במילים אחרות, כל אטום עם שמונה פרוטונים הוא אטום חמצן. לשני אטומי חמצן יכול להיות מספר שונה של נויטרונים או (אם אחד הוא יון) מספר שונה של אלקטרונים, אך לשניהם תמיד יהיו שמונה פרוטונים.
חלק 2 מתוך 2: מציאת מידע קשור
 מציאת המשקל האטומי. המשקל האטומי מודפס בדרך כלל בשם היסוד המדובר על הטבלה המחזורית ובדרך כלל מחושב במדויק לשתיים או שלוש עשרוניות. זהו המסה הממוצעת האטומית היחידה של היסוד, המותאמת כך שתתאים למה שאתה עשוי למצוא בטבע. מספר זה נמצא ב"יחידות מסה אטומית "(AMU (מאנגלית" יחידת מסה אטומית ")).
מציאת המשקל האטומי. המשקל האטומי מודפס בדרך כלל בשם היסוד המדובר על הטבלה המחזורית ובדרך כלל מחושב במדויק לשתיים או שלוש עשרוניות. זהו המסה הממוצעת האטומית היחידה של היסוד, המותאמת כך שתתאים למה שאתה עשוי למצוא בטבע. מספר זה נמצא ב"יחידות מסה אטומית "(AMU (מאנגלית" יחידת מסה אטומית ")). - יש מדענים שמשתמשים במונח "מסת אטומית יחסית" במקום "משקל אטומי".
 להבין את המסה האטומית. מסה אטומית היא מושג הדומה מאוד לזה של משקל אטומי. ההבדל היחיד הוא שאתה מדבר על אטום ספציפי במקום הממוצע של דגימת בדיקה. גרם ברזל מכיל הרבה אטומים עם מסות הנבדלות מעט זו מזו, כך שאתה מחפש את "המשקל היחסי" כדי למצוא את הממוצע. אם אתה מעוניין רק באטום ברזל ספציפי אחד, לא אכפת לך מהממוצע - אתה מתעניין רק במסה המדויקת של אותו אטום ספציפי.
להבין את המסה האטומית. מסה אטומית היא מושג הדומה מאוד לזה של משקל אטומי. ההבדל היחיד הוא שאתה מדבר על אטום ספציפי במקום הממוצע של דגימת בדיקה. גרם ברזל מכיל הרבה אטומים עם מסות הנבדלות מעט זו מזו, כך שאתה מחפש את "המשקל היחסי" כדי למצוא את הממוצע. אם אתה מעוניין רק באטום ברזל ספציפי אחד, לא אכפת לך מהממוצע - אתה מתעניין רק במסה המדויקת של אותו אטום ספציפי. - בפועל, המסה האטומית בדרך כלל כבר ניתנת לבעיות כימיה הנוגעות לאטום אחד בלבד. הבן את המושג הזה כדי שלא תופתע אם הוא שונה ממשקל האטום.
 מספר עגול למסה. מספר המסה הוא המספר הכולל של פרוטונים בתוספת נויטרונים באטום אחד של יסוד. אתה יכול למצוא את המספר הזה בקלות: פשוט קח את המשקל האטומי הנתון בטבלה המחזורית ועגל למספר השלם הקרוב ביותר.
מספר עגול למסה. מספר המסה הוא המספר הכולל של פרוטונים בתוספת נויטרונים באטום אחד של יסוד. אתה יכול למצוא את המספר הזה בקלות: פשוט קח את המשקל האטומי הנתון בטבלה המחזורית ועגל למספר השלם הקרוב ביותר. - זה עובד מכיוון שנויטרונים ופרוטונים הם סביב 1 AMU והאלקטרונים קרובים ל- 0 AMU. מדידות מדויקות משמשות למשקל אטומי להשגת המספר העשרוני, אך אנו מעוניינים רק במספרים השלמים המספרים לנו את מספר הפרוטונים והניטרונים.
- זכור, שימוש במשקל אטומי ייתן לך ממוצע לדגימה אופיינית. לדגימת ברום מספר מסה של כ- 80, אך כפי שניתן לראות, אטום ברום יחיד כמעט תמיד בעל מספר מסה של 79 או 81.
 חשב את מספר הנויטרונים. עכשיו אתה יודע שהמספר האטומי = מספר פרוטונים, וכי מספר המסה = מספר פרוטונים + מספר נויטרונים. כדי לגלות כמה נויטרונים יש באלמנט, עליך להפחית את המספר האטומי ממספר המסה. להלן מספר דוגמאות:
חשב את מספר הנויטרונים. עכשיו אתה יודע שהמספר האטומי = מספר פרוטונים, וכי מספר המסה = מספר פרוטונים + מספר נויטרונים. כדי לגלות כמה נויטרונים יש באלמנט, עליך להפחית את המספר האטומי ממספר המסה. להלן מספר דוגמאות: - אטום הליום יחיד (He) הוא בעל מספר מסה 4 ומספר אטומי 2. לכן עליו להיות 4 - 2 = 2 נויטרונים יש.
- לדגימת כסף (Ag) מספר מסה של כ -108 (על פי הטבלה המחזורית) ומספר אטומי של 47. בממוצע, לכל אטום כסף במדגם יש 108 - 47 = 61 נויטרונים.
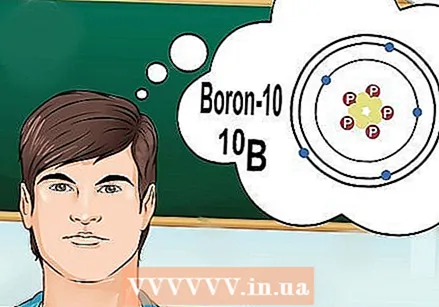 להבין מה זה איזוטופים. איזוטופ הוא צורה ספציפית של יסוד עם מספר מסוים של נויטרונים. כששאלת כימיה מתייחסת ל"בורון 10 "או" B ", הכוונה היא לאלמנט בורון עם מספר מסה של 10. השתמש במספר מסה זה במקום בערך הבורון" האופייני ".
להבין מה זה איזוטופים. איזוטופ הוא צורה ספציפית של יסוד עם מספר מסוים של נויטרונים. כששאלת כימיה מתייחסת ל"בורון 10 "או" B ", הכוונה היא לאלמנט בורון עם מספר מסה של 10. השתמש במספר מסה זה במקום בערך הבורון" האופייני ". - לאיזוטופים אין מספר אטומי שונה. לכל איזוטופ של יסוד יש מספר זהה של פרוטונים.
טיפים
- לחלק מהיסודות הכבדים יותר משקל אטומי הנמצא בסוגריים או בסוגריים. המשמעות היא שהמשקל האטומי הוא המסה המדויקת של האיזוטופ היציב ביותר, ולא הממוצע של איזוטופים מרובים. (אין לכך השפעה על מספר האטום של היסוד.)