מְחַבֵּר:
Bobbie Johnson
תאריך הבריאה:
10 אַפּרִיל 2021
תאריך עדכון:
1 יולי 2024

תוֹכֶן
תהליך פיצול מים (ח2O) למרכיביו (מימן וחמצן) באמצעות חשמל נקרא אלקטרוליזה. הגזים המתקבלים כתוצאה מאלקטרוליזה ניתנים לשימוש בכוחות עצמם - למשל מימן משמש כאחד ממקורות האנרגיה הנקיים ביותר. למרות ששמו של תהליך זה עשוי להישמע מעט חכם, הוא למעשה קל יותר מכפי שנראה אם יש ברשותך הציוד, הידע והניסיון הנכון.
צעדים
חלק 1 מתוך 2: הכינו את הציוד
 1 קח כוס 350 מ"ל ושפוך לתוכה מים חמים. אין צורך למלא את הכוס עד אפס מקום, מספיק רק מעט מים. מים קרים יספיקו, אם כי מים חמים מוליכים חשמל טוב יותר.
1 קח כוס 350 מ"ל ושפוך לתוכה מים חמים. אין צורך למלא את הכוס עד אפס מקום, מספיק רק מעט מים. מים קרים יספיקו, אם כי מים חמים מוליכים חשמל טוב יותר. - גם מי ברז וגם בקבוקי מים יספיקו.
- למים חמים יש צמיגות נמוכה יותר, מה שמקל על היונים להסתובב.
 2 ממיסים כף (20 גרם) מלח שולחן במים. יוצקים מלח לכוס ומערבבים את המים להמסה. זה ייצור פתרון מלוח.
2 ממיסים כף (20 גרם) מלח שולחן במים. יוצקים מלח לכוס ומערבבים את המים להמסה. זה ייצור פתרון מלוח. - נתרן כלוריד (כלומר מלח שולחן) הוא אלקטרוליט המגביר את המוליכות החשמלית של מים. כשלעצמם מים אינם מוליכים חשמל היטב.
- לאחר שתגדיל את המוליכות החשמלית של המים, הזרם שנוצר על ידי הסוללה יעבור ביתר קלות דרך הפתרון ויפרק ביעילות יותר את המולקולות למימן וחמצן.
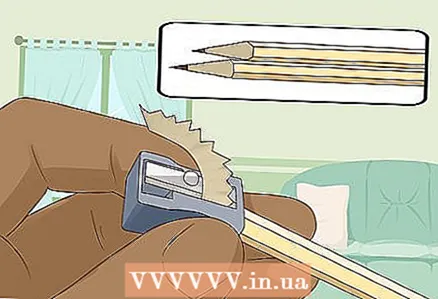 3 משחיזים שני עפרונות רכים קשים משני קצותיהם כדי לחשוף את העופרת. אל תשכח להסיר את המחק מהעפרונות שלך. מוט גרפיט צריך לבלוט משני קצותיו.
3 משחיזים שני עפרונות רכים קשים משני קצותיהם כדי לחשוף את העופרת. אל תשכח להסיר את המחק מהעפרונות שלך. מוט גרפיט צריך לבלוט משני קצותיו. - מוטות הגרפיט ישמשו כאלקטרודות מבודדות שאליהן אתם מחברים את הסוללה.
- הגרפיט מתאים היטב לניסוי זה מכיוון שהוא אינו מתמוסס או מתכלה במים.
 4 חותכים דף קרטון גדול מספיק כדי להניח אותו על גבי הכוס. השתמש בחתיכת קרטון עבה למדי שלא תיפול לאחר שתנקב בה שני חורים. חותכים חתיכה מרובעת מקופסת נעליים או דומה.
4 חותכים דף קרטון גדול מספיק כדי להניח אותו על גבי הכוס. השתמש בחתיכת קרטון עבה למדי שלא תיפול לאחר שתנקב בה שני חורים. חותכים חתיכה מרובעת מקופסת נעליים או דומה. - הקרטון משמש לאחיזת העפרונות במים כך שהם לא יגעו בדפנות ובתחתית הכוס.
- קרטון אינו מוליך, כך שתוכל לשים אותו בבטחה על כוס.
 5 השתמש בעפרונות כדי לתקוע שני חורים בקרטון. פירס את הקרטון בעפרונות - במקרה זה הם יהיו מהודקים היטב ולא יחליקו. וודא כי הגרפיט אינו נוגע בדפנות או בתחתית הכוס, אחרת הוא יפריע לניסוי.
5 השתמש בעפרונות כדי לתקוע שני חורים בקרטון. פירס את הקרטון בעפרונות - במקרה זה הם יהיו מהודקים היטב ולא יחליקו. וודא כי הגרפיט אינו נוגע בדפנות או בתחתית הכוס, אחרת הוא יפריע לניסוי.
חלק 2 מתוך 2: ערוך ניסוי
 1 חבר חוט אחד עם קליפי תנין לכל מסוף סוללה. הסוללה תשמש מקור לזרם חשמלי, ודרך החוטים עם מהדקים ומוטות גרפיט, הזרם יגיע למים.חבר חוט אחד עם מהדק לחיובי והשני למסוף השלילי של הסוללה.
1 חבר חוט אחד עם קליפי תנין לכל מסוף סוללה. הסוללה תשמש מקור לזרם חשמלי, ודרך החוטים עם מהדקים ומוטות גרפיט, הזרם יגיע למים.חבר חוט אחד עם מהדק לחיובי והשני למסוף השלילי של הסוללה. - השתמש בסוללה של 6 וולט. אם אין ברשותך סוללה, תוכל להשתמש במקום זאת בסוללה של 9 וולט.
- ניתן להשיג סוללה מתאימה מחנות ציוד חשמל או סופרמרקט.
 2 חבר את הקצוות האחרים של החוטים לעפרונות. חבר את מהדק חוטי המתכת היטב למוטות הגרפיט. ייתכן שיהיה עליך לקלף עוד קצת עץ מהעפרונות כדי שהקליפים לא יחליקו ממוטות הגרפיט.
2 חבר את הקצוות האחרים של החוטים לעפרונות. חבר את מהדק חוטי המתכת היטב למוטות הגרפיט. ייתכן שיהיה עליך לקלף עוד קצת עץ מהעפרונות כדי שהקליפים לא יחליקו ממוטות הגרפיט. - כך תסגור את המעגל והזרם מהסוללה יזרום במים.
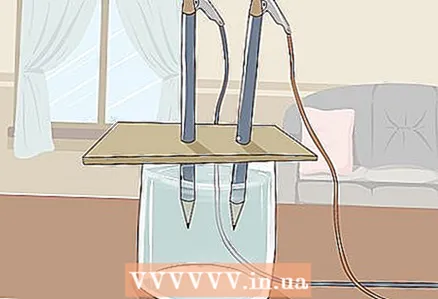 3 הניחו את הקרטון על הזכוכית כך שהקצוות החופשיים של העפרונות יהיו שקועים במים. יריעת הקרטון צריכה להיות גדולה מספיק כדי לנוח על הזכוכית. היזהר לא להפריע למיקום הנכון של העפרונות.
3 הניחו את הקרטון על הזכוכית כך שהקצוות החופשיים של העפרונות יהיו שקועים במים. יריעת הקרטון צריכה להיות גדולה מספיק כדי לנוח על הזכוכית. היזהר לא להפריע למיקום הנכון של העפרונות. - כדי שהניסוי יצליח, אסור שהגרפיט יגע בקירות ובתחתית הזכוכית. בדוק זאת שוב והתאם את העפרונות במידת הצורך.
 4 צפה במים המתפצלים למימן וחמצן. בועות גז יתחילו לעלות ממוטות הגרפיט הטבולים במים. אלה מימן וחמצן. מימן ישתחרר בקוטב השלילי וחמצן בקוטב החיובי.
4 צפה במים המתפצלים למימן וחמצן. בועות גז יתחילו לעלות ממוטות הגרפיט הטבולים במים. אלה מימן וחמצן. מימן ישתחרר בקוטב השלילי וחמצן בקוטב החיובי. - ברגע שאתה מחבר את החוטים לסוללה ולמוטות הגרפיט, זרם חשמלי יזרום במים.
- בועות גז נוספות ייווצרו על העיפרון המחובר לקוטב השלילי, שכן כל מולקולת מים מורכבת משני אטומי מימן ואטום חמצן אחד.
טיפים
- אם אין לך עפרונות עם פיר גרפיט, תוכל להשתמש בשני חוטים קטנים במקום. פשוט כרוך קצה אחד של כל חוט סביב מוט הסוללה המתאים וטבול את השני במים. התוצאה תהיה זהה לזה של עפרונות.
- נסה להשתמש בסוללה אחרת. כמות הזרם הזרם תלויה במתח הסוללה, אשר בתורו משפיע על קצב פיצול מולקולות המים.
אזהרות
- אם אתה מוסיף אלקטרוליט, כגון מלח, למים, זכור כי הניסוי ייצר כמות קטנה של תוצר לוואי כגון כלור. זה בטוח בכמויות כל כך קטנות, אבל אתה יכול להריח ריח קל של כלור.
- בצע ניסוי זה בהשגחת מבוגר. הוא קשור לחשמל וגזים ולכן יכול להיות מסוכן, אם כי לא סביר.
מה אתה צריך
- שני עפרונות קשים-רכים
- סוללה אחת של 6 או 9 וולט
- זכוכית בנפח 350 מיליליטר
- 2 חוטים עם קליפ תנין
- מחדד לעיפרון
- מלח



